Bactériophage
Un bactériophage (ou phage) est un virus n'infectant que des bactéries.
En grec, phageton signifie nourriture/consommation.
On les appelle également virus bactériens.
Ce sont des outils fondamentaux de recherche et d'étude en génétique moléculaire.
Les bactériophages servent entre autres, de vecteurs de clonage de gènes.
Les bactériophages sont présents dans l'ensemble de la biosphère. En effet, ils sont présents partout, mais en quantité plus importante dans les excréments, le sol et les eaux d'égout.
Le support génomique des bactériophages peut être un ADN ou un ARN.

Caractéristiques
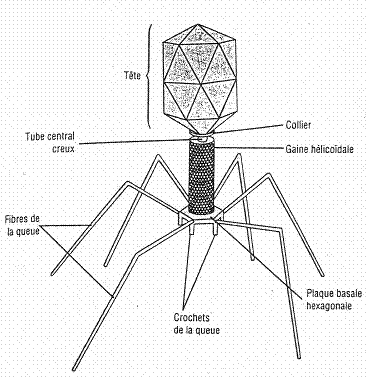
Constitution
Structure d'un bactériophage.
Comme les virus qui infectent les eucaryotes, les phages sont constitués :
- d'une enveloppe protéique externe (appelée capside) protégeant
- le matériel génétique (ADN ou ARN). Pour plus de 95 % des phages connus, ce matériel est une molécule
d'ADN double-brin d'une taille de 5 à 650 kpb et leur taille varie de 24 à 200 nm.
L’organisme responsable de la nomenclature et de la taxonomie des virus s’appelle l’International Commitee on Taxonomy of Viruses (ICTV).
On dénombre 21 morphologies différentes chez les virus bactériens actuellement reconnus par l'ICTV.
En 2000, plus de 5000 bactériophages différents avaient été observés et décrits.
Plus de 95 % d'entre eux possédaient une queue impliquée dans l'entrée de l'ADN du phage dans la cellule bactérienne.
Dans les années 1940, les travaux effectués sur les bactériophages ont permis de découvrir que les acides nucléiques étaient les principaux constituants du matériel génétique. C'est avec cette découverte que prit naissance le vaste domaine de la biologie moléculaire.
***Reproduction
Les phages sont spécifiques et ne peuvent infecter qu'une seule bactérie. On s'entend dans la recherche médicale pour dire que "chaque bactérie possède son phage". Certains phages sont virulents, c'est-à-dire qu'aussitôt qu'ils infectent une cellule, elle se met immédiatement à se reproduire et, dans un court laps de temps, le phage fait exploser la cellule ce qui dégage de nombreux autres phages.
Le fameux microbiologiste Mark Müller a dit un jour : « Les bactéries ne meurent pas, elles explosent en multiples phages. » Certains bactériophages (appelés moyen phages) peuvent entrer dans un état assez inoffensif en entrant leur matériel génétique dans l'ADN de l'hôte (la bactérie) comme un rétrovirus ou comme des plasmides. Ces phages endogènes, référés comme prophages, sont copiés à chaque division cellulaire avec l'ensemble avec l'ADN de la bactérie. L'ADN de celle-ci n'est pas détruit, au contraire ! Ses gènes peuvent être transférés par l'intermédiaire du prophage. Quand la cellule montre quelques signes de stress (cela peut vouloir dire qu'elle va bientôt mourir) le phage endogène commence encore à être actif et commence son cycle reproductif. Ce qui en résulte, c'est la multiplication du phage à l'intérieur de la cellule. Un exemple est la lambda phage de Escherichia coli. Parfois, les prophages apportent quelque chose à la relation bactérie-phage quand la cellule est en dormance, en ajoutant de nouvelles fonctions au génome de la bactérie, un phénomène appelé conversion lysogène. Un exemple connu est l'inoffensive bactérie Vibrio qui, quand elle est transformée par un phage, cause le choléra !
**Cycles lytique et lysogénique
Les bactériophages, ubiquitaires de nature, persistent dans le monde bactérien sous deux états distincts : en tant que
- phage virulent (qui se réplique dans une cellule bactérienne réceptive)
- ou sous forme lysogène (inséré dans le génome sous la forme d’un prophage, il devient partie intégrante du génome de l’hôte).
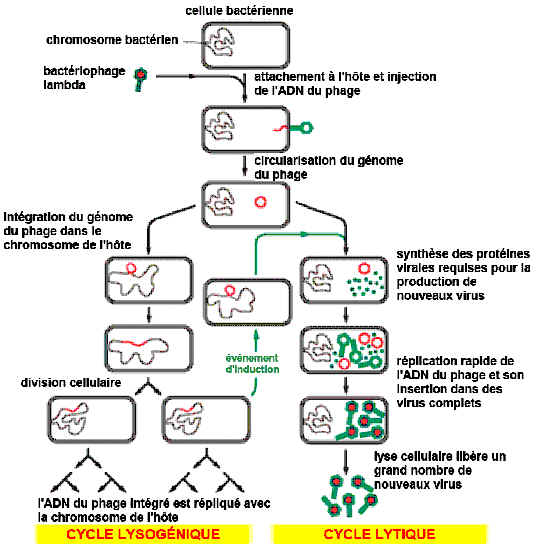
Tous les virus bactériophages ont un cycle lytique (infectieux) pendant lequel le virus, incapable de se reproduire par ses propres moyens, injecte son matériel génétique dans la bactérie.
Grâce aux enzymes et aux ribosomes de l'hôte, le virus peut être répliqué à plus de cent exemplaires avant que l'hôte n'éclate. Mais parfois, certains bactériophages se comportent autrement. Leur matériel génétique s'intègre au chromosome de la bactérie qui le transmet à ses descendants (lysogénie). Dans un cas pour cent mille, l'ADN viral est activé et entame un cycle lytique.
Les bactériophages participent à l'évolution des bactéries
Comme les phages peuvent porter dans leur génome des gènes accessoires à leur cycle de vie, ils participent aux
transferts horizontaux de gènes entre populations bactériennes.
C'est la transduction. La transduction est un transfert de matériel génétique (ADN chromosomique ou extra-chromosomique) par des bactériophages dits transducteurs. Compte tenu de l'étroite spécificité existant entre les phages et les bactéries, ces transferts se font essentiellement entre bactéries appartenant à une même espèce.
Lorsque ces gènes accessoires codent des facteurs de virulence,
la bactérie infectée voit son pouvoir pathogène augmenté – c’est le phénomène de « conversion lysogénique ».
Exemple
Un exemple bien connu est celui des gènes des toxines Stx des Escherichia coli entérohémorragiques (EHEC). Ces gènes stx sont localisées dans des séquences de bactériophages lambdoïdes intégrés dans le chromosome. Les EHEC auraient donc émergé par conversion lysogénique.
On connaît de nombreux autres exemples de ce type, comme la
toxine cholérique de Vibrio cholerae qui est portée par le phage CTX.
Transduction généralisée
La transduction généralisée est due à des phages virulents. Lors du cycle productif, l'ADN bactérien est détruit par une désoxyribonucléase d'origine phagique. Au moment de la morphogénèse, un fragment d'ADN bactérien peut être encapsidé par erreur et venir remplacer l'ADN phagique.
Le phage ayant incorporé de
l'ADN bactérien ne peut plus de répliquer (phage défectif), mais il peut
transférer de l'ADN bactérien à une bactérie réceptrice (les étapes
d'adsorption et de pénétration ne sont pas modifiées chez un phage défectif).
Cette transduction est qualifiée de généralisée ou de non spécifique car
elle concerne tous les fragments d'ADN (chromosomique ou extra-chromosomique)
pourvu que leur taille soit compatible avec une encapsidation.
Après le transfert d'ADN dans
une bactérie réceptrice, deux modalités sont possibles.
. Dans certains cas le fragment
d'ADN va s'intégrer par recombinaison homologue et toute la descendance de la
bactérie réceptrice portera l'ADN transféré. On dit que la transduction
est complète.
Transduction localisée
La transduction localisée est réalisée par des phages tempérés.
Elle ne correspond pas à une erreur d'encapsidation mais à une excision anormale du prophage.
Lorsque le répresseur est inactivé, un cycle productif succède à un cycle lysogénique.
Dans les conditions normales, l'ADN phagique est excisé dans son intégralité.
Toutefois, avec une fréquence de l'ordre de 10-6, l'excision est anormale et on obtient la libération d'une molécule d'ADN hybride constituée d'un fragment d'ADN phagique et d'un fragment d'ADN bactérien. Ce fragment d'ADN bactérien est adjacent à la zone d'intégration du prophage d'où le nom de transduction localisée.
*Les bactériophages comme outil fondamental de recherche
Les phages ont permis différentes découvertes :
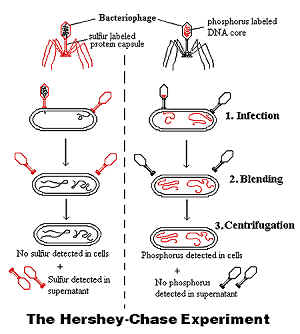
L'expérience de Harshey et Chase qui a permis de confirmer la fonction de l'ADN en tant que support de l'information génétique.
En 1980, le biochimiste britannique Frederick Sanger reçut le prix Nobel pour avoir réussi à
séquencer l'ADN en utilisant un phage.
L'étude des phages a des implications importantes en médecine et en génétique, en particulier pour la compréhension des infections virales, des anomalies génétiques, de l'embryologie humaine, des causes du cancer et de la résistance des bactéries aux antibiotiques.
Conséquences et applications
Modèles d'étude en génie génétique
Du fait de leur simplicité structurale, les bactériophages ont servi de modèle d'études et ils ont permis de découvrir la plupart des notions fondamentales de la biologie moléculaire moderne (caractère discontinu de la réplication de l'ADN, enzymes de restriction, mécanismes de la régulation de l'expression des gènes, etc.).
Les phages sont utilisés de multiples manières dans la biologie moléculaire.
Ils sont utilisés comme vecteurs de clonage pour insérer de l'ADN dans les bactéries.
Utilisation dans le séquençage de génomes entiers
Le séquençage d'un génome ne se fait pas d'un seul coup, mais petit à petit sur des fragments de génomes. Pour cela ces fragments d'ADN doivent être stockés et multipliés dans des organismes servant de banque d'ADN. Les phages en tant que vecteurs de clonage le permettent.
Importance industrielle
Les bactériophages peuvent avoir des répercussions industrielles majeures pour les industries de fermentation qui utilisent des souches bactériennes (industries laitières, production d'antibiotiques, production de protéines eucaryotes, ...). Les phages peuvent en effet contaminer et détruire les souches bactériennes utilisées. L'application de mesures strictes de désinfection des locaux et de l'appareillage, ainsi que l'utilisation de souches résistantes aux phages permettent de prévenir ces risques.
Utilisation des phages en tant qu'agent anti-microbien
En 2006, aux États-Unis, une préparation à base de six virus bactériophages a été autorisée comme conservateur alimentaire, notamment, pour lutter contre la listériose.
Utilisation en Médecine comme traitement.
En ex-urss et plus particulièrement en Géorgie et en Pologne, les phages sont utilisés pour traiter les infections bactériennes avec ou sans adjonction de traitement antibiotique. Dans de nombreux cas, les phages sont aussi efficaces que les antibiotiques et souvent même supérieurs, notamment dans les cas d'infections chroniques.
**Utiliser les bactérie comme un moyen d'identifier les bactéries : la lysotypie
La sensibilité aux bactériophages
peut être variable selon les souches d'une même espèce. L'utilisation d'une série
de phages convenablement choisis (lysotypie) permet de caractériser des
lysovars. La lysotypie est une méthode très discriminante pour des études épidémiologiques
et elle a été appliquée à l'études d'épidémies provoquées par Listeria
monocytogenes, diverses salmonelles, Staphylococcus aureus,
Vibrio cholerae, etc.
L'utilisation des techniques de biologie moléculaire a fait diminuer l'intérêt
de la lysotypie pour des enquêtes épidémiologiques. Toutefois son coût est
faible et la lysotypie reste utilisée lorsqu'il faut étudier un nombre élevé
de souches.
La numération des phages.On a déterminé les titres des phages (unités formant des plaques (UFP) par unité de volume.
Exemple de phages dans l'air ambiant.
Pour évaluer la teneur en bactériophages de l'air ambiant des usines fabriquant des fromages frais, on a prélevé des échantillons d'air à l'aide d'un appareil de prise d'échantillon d'air et développé une méthode de routine simple pour transporter et préparer les échantillons et pour déterminer ensuite les titres phagiques. L'échantillonnage était effectué sur des filtres de gélatine qui étaient dissous dans un simple système tampon et soudés dans des sacs en plastique stériles pour transporter les échantillons (une solution de Ringer (1/4) à laquelle était additionné 10% (vol/vol) du lait écrémé s'est avérée appropriée). On a déterminé les titres des phages (unités formant des plaques (UFP) par m3 d'air ambiant) à l'aide des isolats sensibles aux phages du levain utilisé (Lactococcus lactis). Sur les filtres de gélatine les phages collectés ont montré, dans des conditions de stockage et de transport normales, une stabilité tout à fait satisfaisante - même après un stockage prolongé pendant plusieurs jours à des températures différentes et une valeur répétable des titres phagiques. La méthode s'est avérée appropriée pour les différents types de phages qui sont très répandus dans les usines transformatrices du lait (en particulier les phages à tête isométrique et à tête allongée (prolate) des espèces 936 et c2). La limite inférieure de détection de la méthode était inférieure à 5 UFP/m 3 d'air ambiant (échantillonnage de 12 min, volume aspiré : 100 litres/min). A proximité des séparateurs qui se sont avérés une source essentielle d'aérosols de phages, on a mesuré une teneur allant jusqu'à 2x108 UFP/m3 d'air ambiant. Dans la zone de production, on a établi un gradient de concentration descendant jusqu'à 2x102 UFP par m3 d'air ambiant à proximité des tanks de fermentation.
|
BTS QIABI 1999
4. Fabrication industrielle (20
points) La qualité des produits
fromagers repose à la fois sur la qualité microbiologique du lait utilisé
et sur l'emploi de levains sélectionnés. Ces levains doivent, en
particulier, être résistants aux bactériophages présents dans le
milieu de culture (lait). 4.1. Définir un bactériophage. virus qui
parasite une bactérie 4.2. La détection des bactériophages
peut se réaliser par une technique rapide: dosage d'ATP par
bioluminescence. Le dosage d'ATP permet d'évaluer
la biomasse cellulaire en reposant sur trois principes de base: tous les
organismes vivants contiennent un taux constant d'ATP, l'ATP n'est jamais
présent dans les cellules mortes, l'ATP peut être extrait
facilement et dosé de manière précise. Le système bioluminescent
classique est celui de la luciole (Photinus pyralis) utilisant le complexe
luciférine-luciférase. luciférase luciférine + ATP + 02
-4
oxyluciférine + AMP + PPi + CO2 + hv (L = 560 nm) Mg2+ 4.2.1. Quelle relation peut-on
établir entre la teneur en ATP et la bioluminescence ? 4.2.1 (2 points) l'équation donnée montre qu'il y a proportionnalité entre la bioluminescence et la concentration d'ATP :( hv = k [ ATP]). 4.2.2. L'activité des bactériophages
peut être révélée expérimentalement par le suivi de la croissance de
souches bactériennes issues de ferments industriels : souche de streptocoques S1
cultivée sur milieu M17: culture S1a, souche de streptocoques S1
cultivée sur milieu M17 et contaminée au temps t = 3 h 30. durant la
phase exponentielle par le bactériophage Phi 1 culture S1b souche de streptocoques lysogènes
52 cultivée sur milieu M17: culture S2a, souche de streptocoques lysogènes
S2 cultivée sur milieu M17 en présence de mitomycine (MC) culture 52b. L'annexe 4 présente les résultats des courbes de croissance obtenues par dosage de l'ATP. 4.2.2.1. Donner l'allure générale d'une et nommer les différentes phases. Délimiter et nommer les différentes phases.
4.2.2.2. Commenter la courbe de croissance obtenue avec le témoin de croissance (annexe 4, figure I ).
4.2.2.3. Préciser l'activité du bactériophage phi 1 ainsi mise en évidence; justifier la réponse.
4.2.2.4. Définir une souche lysogène . En
absence de mitomycine, on observe une croissance normale de S2. En présence
de mitomycine : N [ATP] -> lyse des bactéries - rupture de la lysogénie
et amorçage d'un cycle lytique. ·
bactérie avec prophage dans le chromosome ·
mitomycine = agent inducteur, transforme le prophage en phage végétatif
lequel entame un cycle lytique à décrire.
|